Det bemerkelsesverdige karbonatomet
Av Jonathan McLatchie, June 19, 2024. Oversatt herfra
 I en artikkel gårsdagen -lenke, diskuterte jeg den utrolige utformingen av ikke-metallatomer, og den påfallende tilfeldigheten at selve atomene som man kan bygge stabile, definerte former ut fra, også gir oss den hydrofobe kraften, som er nøkkelen til å ordne dem i høyere nivås strukturer. Her vil jeg diskutere egnetheten til karbon for livet, og de utrolige suksessrike omstendighetene som fremmer dens overflod i universet.
I en artikkel gårsdagen -lenke, diskuterte jeg den utrolige utformingen av ikke-metallatomer, og den påfallende tilfeldigheten at selve atomene som man kan bygge stabile, definerte former ut fra, også gir oss den hydrofobe kraften, som er nøkkelen til å ordne dem i høyere nivås strukturer. Her vil jeg diskutere egnetheten til karbon for livet, og de utrolige suksessrike omstendighetene som fremmer dens overflod i universet.
Bilde 1. Bilde av den periodiske tabell på vegen
Karbonets egnethet for liv
Karbonatomet, den primære bestanddelen av organiske molekyler, er, i flere henseender, unikt egnet til montering av de komplekse makromolekylene som finnes i cellen. For det første, på grunn av stabiliteten i karbon-karbonbinding, kan bare karbon danne lange polymerer av seg selv, danne lange kjeder eller ringer, samtidig som de bindes til andre typer atomer. Selv om silisium også kan danne lange kjeder ved å binde seg til seg selv, er disse bindingene betydelig mindre stabile enn karbon-karbonbindinger. Plaxco og Gross bemerker at "Mens silisium-silisium, silisium-hydrogen og silisium-nitrogenbindinger er like i energi, er silisium-oksygenbindingen langt mer stabil enn noen av de tre andre typene. Som en konekvens oksiderer silisium lett til silisiumdioksid, og begrenser kjemien som er tilgjengelig for dette atomet, når oksygen er til stede. Og oksygen er det tredje vanligste atomet i universet. Som Primo Levi forklarer, er karbon "det eneste elementet som kan binde seg i lange stabile kjeder uten stor energikostnad, og for livet på jorden (det eneste vi kjenner så langt), er det nettopp nødvendig med lange kjeder. Derfor er karbon det viktigste elementet i levende stoff". (2)
For det andre er karbon tetravalent - det vil si at hvert atom kan danne fire kovalente bindinger med andre atomer. For det tredje besitter karbon en relativt liten 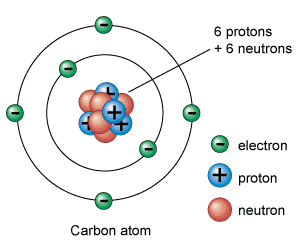 atomkjerne, som medfører korte bindingsavstander, og lar det dermed danne stabile bindinger med seg selv og andre atomer. Denne egenskapen er også besatt av de andre små, ikke-metallatomene i periode to. Karbon er i stand til å danne enkelt-, dobbelt- og trippelbindinger med andre atomer. Nitrogen kan også danne enkelt-, dobbelt- eller trippelbindinger og oksygen kan danne enkelt- og dobbeltbindinger. Kontraster dette med ikke -metallatomene rett under dem i den periodiske tabellen - silisium, fosfor og svovel - som har større atomradier, og mindre lett danner slike bindinger, på grunn av at flere bindinger har redusert stabilitet.
atomkjerne, som medfører korte bindingsavstander, og lar det dermed danne stabile bindinger med seg selv og andre atomer. Denne egenskapen er også besatt av de andre små, ikke-metallatomene i periode to. Karbon er i stand til å danne enkelt-, dobbelt- og trippelbindinger med andre atomer. Nitrogen kan også danne enkelt-, dobbelt- eller trippelbindinger og oksygen kan danne enkelt- og dobbeltbindinger. Kontraster dette med ikke -metallatomene rett under dem i den periodiske tabellen - silisium, fosfor og svovel - som har større atomradier, og mindre lett danner slike bindinger, på grunn av at flere bindinger har redusert stabilitet.
En annen egenskap av organiske bindinger, er at styrken deres sitter i en Gullhårs-sone, og verken er for sterk eller for svak for biokjemiske manipulasjoner i cellen. Hvis styrken til disse bindingene skulle endres med en enkelt størrelsesorden, ville det gjøre mange biokjemiske reaksjoner som finner sted i cellen, umulige. Hvis den var for sterk, kunne ikke aktiveringsenergien som trengs for å bryte bindinger reduseres tilstrekkelig med enzymatisk aktivitet (enzymer stresser kjemiske bindinger ved å delta i spesifikke konformasjonsbevegelser, mens de er bundet til et substrat). Motsatt, hvis organiske bindinger var mye svakere, ville obligasjoner ofte bli forstyrret av molekylære kollisjoner, noe som gjør kontrollert kjemi umulig.
Bilde 2. Carbonatom (C12)-skjematisk
 Et annet spesielt kjennetegn ved karbon er at det ikke er mye variasjon i energinivået av karbonbindinger fra det ene atomet til det neste. Robert E. D. Clark forklarer at karbon "er en venn til alle. Bindingsenergien med hydrogen, klor, nitrogen, oksygen eller til og med en annen karbonforskjell, er liten. Ingen andre atomer er lik det. Å sløse for stor energikostnad for å konvertere noen av disse til en annen .. gitt alt dette, er det ikke rart at i størrelsesorden ti millioner unike karbonforbindelser er blitt beskrevet av kjemikere, som er så mange som alle beskrevne ikke-karbon-forbindelser samlet.
Et annet spesielt kjennetegn ved karbon er at det ikke er mye variasjon i energinivået av karbonbindinger fra det ene atomet til det neste. Robert E. D. Clark forklarer at karbon "er en venn til alle. Bindingsenergien med hydrogen, klor, nitrogen, oksygen eller til og med en annen karbonforskjell, er liten. Ingen andre atomer er lik det. Å sløse for stor energikostnad for å konvertere noen av disse til en annen .. gitt alt dette, er det ikke rart at i størrelsesorden ti millioner unike karbonforbindelser er blitt beskrevet av kjemikere, som er så mange som alle beskrevne ikke-karbon-forbindelser samlet.
Bilde 3. Carbon-12 er stabilt
Karbonresonans
Som vi har sett, er karbon helt grunnleggende for livet. Det er også - etter hydrogen, helium og oksygen - det fjerde mest tallrike elementet i galaksen vår. En karbonkjerne kan genereres ved å knuse sammen to kjerner av helium-4 for å lage beryllium-8 (som inneholder fire protoner og fire nøytron) og deretter tilsette en ytterligere kjerne av helium for å generere karbon-12 (som inneholder seks protoner og seks nøytroner). Beryllium er imidlertid ganske ustabilt, og kan forventes å bryte fra hverandre i to kjerner av helium i 10 ^-16 sekunder. Noen ganger kolliderer en tredje heliumkjerne før den går i stykker med beryllium, noe som resulterer i en karbonkjerne. Mens det skjer, har karbonatomisk en spesiell kvanteegenskap som er en resonans, som letter denne prosessen. En resonans beskriver de diskrete energinivåene som protoner og nøytron i kjernen kan eksistere. Det viser seg faktisk at resonansen av karbonatomene, akkurat viser seg å skje i samsvar med den kombinerte energien til berylliumatom og en kolliderende heliumkjerne.
 Som Geraint Lewis og Luke Barnes forklarer, "Hvis det var en resonans på akkurat det rette stedet i karbon, ville den kombinerte energien til beryllium og heliumkjerner resultere i en karbonkjerne i en av de opphøyde tilstandene. Den berørte karbonkjernen vet hvordan den skal håndtere overflødig energi, uten bare å falle fra hverandre. Det er mindre sannsynlig at den går i oppløsning, og mer sannsynlig å forfalle til grunntilstanden med utslipp av et gammastråle-foton. Karbonformet, energi frigitt .. suksess!" (5) Uten dette spesifikke resonansnivået, ville universet inneholde relativt få karbonatomer - i 1953 ble denne spesifikke resonansen som tidligere hadde blitt spådd av Fred Hoyle oppdaget av William Fowler, nettopp der Hoyle hadde spådd at den ville være.
Som Geraint Lewis og Luke Barnes forklarer, "Hvis det var en resonans på akkurat det rette stedet i karbon, ville den kombinerte energien til beryllium og heliumkjerner resultere i en karbonkjerne i en av de opphøyde tilstandene. Den berørte karbonkjernen vet hvordan den skal håndtere overflødig energi, uten bare å falle fra hverandre. Det er mindre sannsynlig at den går i oppløsning, og mer sannsynlig å forfalle til grunntilstanden med utslipp av et gammastråle-foton. Karbonformet, energi frigitt .. suksess!" (5) Uten dette spesifikke resonansnivået, ville universet inneholde relativt få karbonatomer - i 1953 ble denne spesifikke resonansen som tidligere hadde blitt spådd av Fred Hoyle oppdaget av William Fowler, nettopp der Hoyle hadde spådd at den ville være.
Bilde 4. Fred Hoyle -endret seg fra ateist til deist -grunnet karbonresonanssen.
Et bemerkelsesverdig tilfeldighet
Denne spesielle karbonresonansen (kjent som Hoyle tilstanden), tilsvarer energinivåene til den kombinerte beryllium-8-kjernen og en helium-4-kjerne og gjør den ellers usannsynlige prosessen med karbon-12-dannelse, gjennomførbar og effektiv i miljøer med høye temperaturer i stjernekjerner.. Denne delikate balansen mellom energinivået er et bemerkelsesverdig aspekt ved kjerne- astrofysikk, som gir mulighet for å skape elementene nødvendige for livet. Hvis det ikke var for denne spesielle resonansen, ville livet sannsynligvis ikke eksistert i vårt univers. Dette er et annet av mange utallige trekk i vårt univers som må være "helt riktig" for at livet - spesielt avansert liv - skal eksistere.
Referanser til slutt i originalartikkelen -lenke.
 JONATHAN MCLATCHIE -Bilde 5
JONATHAN MCLATCHIE -Bilde 5
Resident biolog & stipendiat, Center for Science and Culture
Dr. Jonathan McLatchie har en bachelorgrad i rettsmedisinsk biologi fra University of Strathclyde, en mastergrad (M.Res) i evolusjonsbiologi fra University of Glasgow, en annen mastergrad i medisinsk og molekylær biovitenskap fra Newcastle University, og en doktorgrad i evolusjonær Biologi fra Newcastle University. Tidligere var Jonathan assisterende professor i biologi ved Sattler College i Boston, Massachusetts. Jonathan har blitt intervjuet på podcaster og radioprogrammer, inkludert "Unbelievable?" på Premier Christian Radio og mange andre. Jonathan har talt internasjonalt i Europa, Nord-Amerika, Sør-Afrika og Asia for å fremme bevis på design i naturen.
Oversettelse, via google oversetter, og bilder ved Asbjørn E. Lund
 I en artikkel gårsdagen -lenke, diskuterte jeg den utrolige utformingen av ikke-metallatomer, og den påfallende tilfeldigheten at selve atomene som man kan bygge stabile, definerte former ut fra, også gir oss den hydrofobe kraften, som er nøkkelen til å ordne dem i høyere nivås strukturer. Her vil jeg diskutere egnetheten til karbon for livet, og de utrolige suksessrike omstendighetene som fremmer dens overflod i universet.
I en artikkel gårsdagen -lenke, diskuterte jeg den utrolige utformingen av ikke-metallatomer, og den påfallende tilfeldigheten at selve atomene som man kan bygge stabile, definerte former ut fra, også gir oss den hydrofobe kraften, som er nøkkelen til å ordne dem i høyere nivås strukturer. Her vil jeg diskutere egnetheten til karbon for livet, og de utrolige suksessrike omstendighetene som fremmer dens overflod i universet. atomkjerne, som medfører korte bindingsavstander, og lar det dermed danne stabile bindinger med seg selv og andre atomer. Denne egenskapen er også besatt av de andre små, ikke-metallatomene i periode to. Karbon er i stand til å danne enkelt-, dobbelt- og trippelbindinger med andre atomer. Nitrogen kan også danne enkelt-, dobbelt- eller trippelbindinger og oksygen kan danne enkelt- og dobbeltbindinger. Kontraster dette med ikke -metallatomene rett under dem i den periodiske tabellen - silisium, fosfor og svovel - som har større atomradier, og mindre lett danner slike bindinger, på grunn av at flere bindinger har redusert stabilitet.
atomkjerne, som medfører korte bindingsavstander, og lar det dermed danne stabile bindinger med seg selv og andre atomer. Denne egenskapen er også besatt av de andre små, ikke-metallatomene i periode to. Karbon er i stand til å danne enkelt-, dobbelt- og trippelbindinger med andre atomer. Nitrogen kan også danne enkelt-, dobbelt- eller trippelbindinger og oksygen kan danne enkelt- og dobbeltbindinger. Kontraster dette med ikke -metallatomene rett under dem i den periodiske tabellen - silisium, fosfor og svovel - som har større atomradier, og mindre lett danner slike bindinger, på grunn av at flere bindinger har redusert stabilitet. Et annet spesielt kjennetegn ved karbon er at det ikke er mye variasjon i energinivået av karbonbindinger fra det ene atomet til det neste. Robert E. D. Clark forklarer at karbon "er en venn til alle. Bindingsenergien med hydrogen, klor, nitrogen, oksygen eller til og med en annen karbonforskjell, er liten. Ingen andre atomer er lik det. Å sløse for stor energikostnad for å konvertere noen av disse til en annen .. gitt alt dette, er det ikke rart at i størrelsesorden ti millioner unike karbonforbindelser er blitt beskrevet av kjemikere, som er så mange som alle beskrevne ikke-karbon-forbindelser samlet.
Et annet spesielt kjennetegn ved karbon er at det ikke er mye variasjon i energinivået av karbonbindinger fra det ene atomet til det neste. Robert E. D. Clark forklarer at karbon "er en venn til alle. Bindingsenergien med hydrogen, klor, nitrogen, oksygen eller til og med en annen karbonforskjell, er liten. Ingen andre atomer er lik det. Å sløse for stor energikostnad for å konvertere noen av disse til en annen .. gitt alt dette, er det ikke rart at i størrelsesorden ti millioner unike karbonforbindelser er blitt beskrevet av kjemikere, som er så mange som alle beskrevne ikke-karbon-forbindelser samlet. Som Geraint Lewis og Luke Barnes forklarer, "Hvis det var en resonans på akkurat det rette stedet i karbon, ville den kombinerte energien til beryllium og heliumkjerner resultere i en karbonkjerne i en av de opphøyde tilstandene. Den berørte karbonkjernen vet hvordan den skal håndtere overflødig energi, uten bare å falle fra hverandre. Det er mindre sannsynlig at den går i oppløsning, og mer sannsynlig å forfalle til grunntilstanden med utslipp av et gammastråle-foton. Karbonformet, energi frigitt .. suksess!" (5) Uten dette spesifikke resonansnivået, ville universet inneholde relativt få karbonatomer - i 1953 ble denne spesifikke resonansen som tidligere hadde blitt spådd av Fred Hoyle oppdaget av William Fowler, nettopp der Hoyle hadde spådd at den ville være.
Som Geraint Lewis og Luke Barnes forklarer, "Hvis det var en resonans på akkurat det rette stedet i karbon, ville den kombinerte energien til beryllium og heliumkjerner resultere i en karbonkjerne i en av de opphøyde tilstandene. Den berørte karbonkjernen vet hvordan den skal håndtere overflødig energi, uten bare å falle fra hverandre. Det er mindre sannsynlig at den går i oppløsning, og mer sannsynlig å forfalle til grunntilstanden med utslipp av et gammastråle-foton. Karbonformet, energi frigitt .. suksess!" (5) Uten dette spesifikke resonansnivået, ville universet inneholde relativt få karbonatomer - i 1953 ble denne spesifikke resonansen som tidligere hadde blitt spådd av Fred Hoyle oppdaget av William Fowler, nettopp der Hoyle hadde spådd at den ville være. JONATHAN MCLATCHIE -Bilde 5
JONATHAN MCLATCHIE -Bilde 5